medigatenews.com
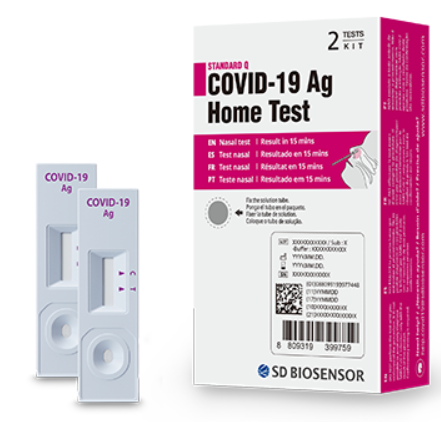
MEDI:GATE NEWS 휴마시스·에스디바이오센서·래피젠 등 7개 회사 8개 제품 자가진단키트 허가사진 = 최근 코로나19 자가검사키트 수요 급증에 따라 약국과 편의점 등에서 대용량 포장제품은 낱개로 나눠 판매 중이다. [메디게이트뉴스 서민지 기자] 오미크론 변이가 우세종이 되면서 코로나19 신규 확진자 수가 연일 최다치를 경신하는 가운데, 항원검사 방식의 자가검사키트 수요가 급증하고 있다. 17일 식품의약품안전처는 현재까지 총 7개 회사의 8개 자가진단키트에 대한 품목허가를 완료했다. 수출용 허가는 40여개 제품에 이른다. 자가검사키트는 문가가 아닌 개인이 직접 코로나19 검사를 할 수 있는 진단시약으로, 사용자는 사용하고자 하는 제품의 사용설명서를 충분히 숙지하고 허가된 사용 방법에 따라 정확하게 사용하는 것이 중요하다. 식약처로부터 국내 품목 허가를 받은 8개 제품은 자가검사키트 허가 기준인 민감도 90% 이상과 특이도 99% 이상을 충족했다. 민감도는 질병이 있는 환자 중 검사결과가 양성으로 나타날 확률이며, 특이도는 질병이 없는 환자 중 검사결과가 음성으로 나타날 확률을 뜻한다. 구체적으로 ▲휴마시스 휴마시스 코비드-19 홈 테스트 ▲에스디바이오센서 스탠다드 큐 코비드-19 홈테스트(STANDARD™ Q COVID-19 Ag Home Test) ▲래피젠 바이오크레디트 코비드-19 홈테스트 나잘(BIOCREDIT COVID-19 Ag Home Test Nasal) ▲젠바디 젠바디 코비드-19 홈테스트(GenBody COVID-19 Ag Home Test) ▲수젠텍 SGTi-flex COVID-19 Ag Self ▲에스디바이오센서 스탠다드 아이큐 코비드-19 홈테스트(STANDARD™ i-Q COVID-19 Ag Home Test) ▲메디안디노스틱 MDx COVID-19 Ag Home Test ▲오상헬스케어 GeneFinder™ COVID-19 Ag Self Test 등이다. 첫 국내 품목허가 휴마시스·에스디바이오센서…코로나19로 중소→중견기업 성장 표 = 코로나19 자가검사키트 허가 현황(식약처 제공). 이중 휴마시스의 휴마시스 코비드-19 홈 테스트와 에스디바이오센서의 스탠다드 큐 코비드-19 홈 테스트 등은 항원방식의 코로나19 진단키트로 지난해 4월 23일 국내에서 처음 허가를 받았다. 휴마시스 진단키트의 민감도는 92.9%, 특이도는 99.0%며, 국내 품목허가 뿐 아니라 해외 수출용으로도 허가를 받았다. 해외 수출의 큰 폭의 증가로 휴마시스는 지난해 연결기준 매출액이 3218억2914만원으로 전년(457억1721만원)대비 6배 이상 증가해 중소기업에서 중견기업으로 탈바꿈했다. 영업이익 역시 전년대비 660% 증가한 1927억5144만원, 당기순이익은 616% 증가한 1499억1604만원으로 역대 최대치를 기록했다. 휴마시스는 지난 2000년 6월 12일에 설립된 의료기기 제조기업으로, 체외진단 중 POCT 면역 분석시약 제품군, POCT 면역정량분석기기 제품군, 신소재·신규마커 개발분야에 특화돼 있다. 현재 암진단분야, 가정용 자가진단제품군, 약물중독진단, 뇨분석제품군 등 면역화학검사분야의 약 100여개의 제품을 개발·생산하고 있으며, 최근 전세계 코로나19 확산에 따라 코로나19 항체·항원진단키트를 수출하고 있다. 앞으로 휴마시스는 코로나19를 포함한 감염성 제품을 신속하게 개발해 글로벌 시장을 확대해 나갈 예정이며, 인공지능(AI), IT기술과 접목한 모바일 헬스케어 분야의 R&D도 추진해 사업영역도 확장해나갈 계획이다. 에스디바이오센서는 스탠다드 큐에 이어 이달 11일 스탠다드 아이-큐 제품까지 잇따라 국내 정식 품목허가를 받았다. 아직 지난해 총 매출이 집계되지 않았으나, 2021년 3분기까지 누적 매출만 2조4862억0355만원이며 영업이익 1조2161억7772만원, 당기순이익 9350억6724만원에 이른다. 사실상 국내 제약바이오기업 중 가장 큰 규모다. 지난해 3분기까지 제품 라인업 확장과 새로운 기술 마련 등을 위한 R&D 비용에 158억5710만원을 투입했다. 투입 규모는 국내 대형 제약사들과 비슷한 수준이지만, 매출이 급증하면서 매출액 대비 연구개발비율은 0.66%에 그쳤다. 에스디바이오센서는 십여년간의 지속적인 연구개발(R&D)과 글로벌 판매 네트워크 확장, 품질관리 시스템·생산량 강화 등으로코로나19 코로나19 염기 서열이 최초 공개된 직후 6주 만에 분자진단 PCR 시약 개발에 성공했다. 이어 7주차에는 항원 신속진단키트 개발을 완료했고, 자체 개발된 코로나19 항원 신속진단제품은 국내 품목허가와 미국 식품의약국(FDA) 긴급사용승인 등을 받았다. 코로나19로 유명해진 기업이지만 이미 150여종의 제품 라인업을 보유하고 있으며, 미래 지속가능 성장을 위해 혈당 측정 시스템부터 면역분석(Immuno-assay) 방법, 중합효소 연쇄반응(PCR) 방법을 이용한 다양한 체외진단 시스템을 개발하는 데 연구 역량을 집중하고 있다. 특히 에스디바이오센서 측은